 Esta línea está basada en las aplicaciones sintéticas de la biocatálisis, usando como biocatalizadores enzimas (libres o inmovilizadas) o sistemas de célula entera, de acuerdo a las necesidades.
Esta línea está basada en las aplicaciones sintéticas de la biocatálisis, usando como biocatalizadores enzimas (libres o inmovilizadas) o sistemas de célula entera, de acuerdo a las necesidades.
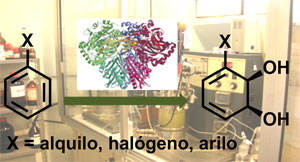
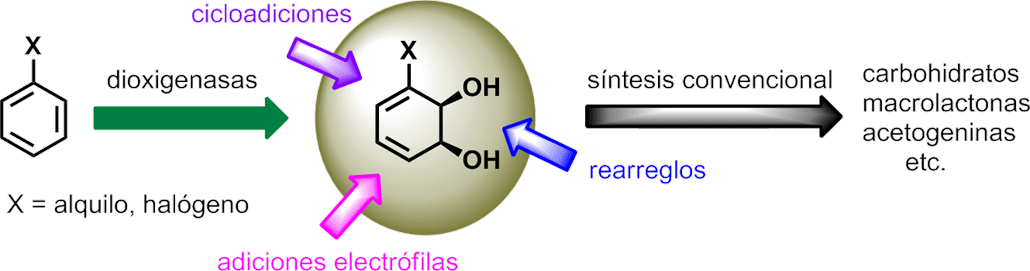
La biotransformación más empleada en el grupo es la dihidroxilación enzimática de compuestos aromáticos simples para producir ciclohexadienodioles homoquirales,1 los cuales se usan posteriormente como material de partida en las secuencias sintéticas de varias líneas de investigación.
Para realizar esta biotransformación, mediada por el complejo enzimático Tolueno Dioxigenasa (TDO), se dispone de dos sistemas de célula entera optimizados por el grupo: la cepa mutante Pseudomonas putida F39/D y el microorganismo recombinante Escherichia coli JM109 (pDTG601). A su vez se está implementando la utilización de otras dos dioxigenasas bacterianas: Clorobenceno Dioxigenasa (CDO) y Dioxigenasa del Ácido Benzoico (BzDO) que permitirán aumentar la diversidad de los cis-ciclohexadienodioles preparados. Para ello se busca expresar dichos sistemas enzimáticos en cepas adecuadas de E. coli y lograr su crecimiento en cultivos de alta densidad a escala de fermentador (5L). Estas actividades se llevan a cabo en el Laboratorio de Biocatálisis y Biotransformaciones con la colaboración de la Prof. Sonia Rodríguez.

Los ciclohexadienodioles obtenidos son muy interesantes desde el punto de vista preparativo debido a su alta funcionalización y a sus varias opciones de reactividad (como dieno, alqueno, alcohol alílico, diol, entre otras), convirtiendo esta biotransformación en una poderosa y ampliamente usada herramienta de síntesis enantioselectiva.2 Además de los aspectos puramente sintéticos de estos dioles, consistentes en su uso en las secuencias sintéticas descritas en otras líneas del grupo, se han realizado contribuciones en aspectos metodológicos, estudiando la reactividad del sistema diénico (en cicloadiciones y reacciones electrófilas) y del sistema diol alílico (selectividad, rearreglos de Claisen). 3
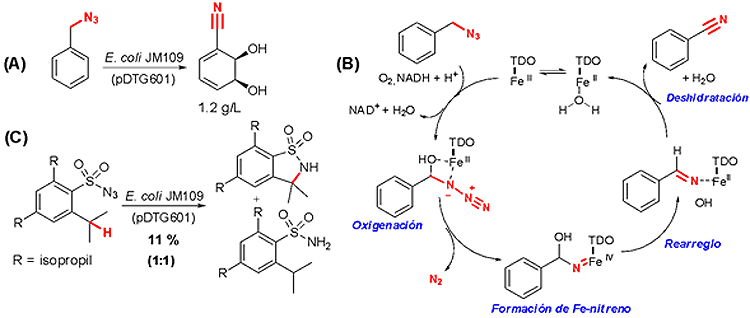
Además del uso de dioxigenasas bacterianas para la preparación de cis-ciclohexadienodioles, nuestro grupo ha desarrollado una nueva línea para estudiar su potencial uso en procesos biocatalíticos que permitan aminación de enlaces C(sp3)-H. Dichos procesos son deseados en los esquemas sintéticos por implicar una funcionalización directa del enlace C-H sin el uso de auxiliares o grupos protectores (lo que determina síntesis cortas y eficientes). Sin embargo, las condiciones tradicionales de aminación C-H implican el uso de metales de transición que generalmente son tóxicos además de condiciones de reacción con altas presiones y temperatura. Por lo tanto, encontrar enzimas que permitan estos procesos constituye un importante desafío experimental. Resultados preliminares de nuestro grupo indican que el complejo enzimático TDO puede promover la descomposición de azidas para generar especies nitrenoides reactivas que pueden rearreglar o insertarse en enlaces C-H. La figura a continuación muestra parte de estos resultados experimentales preliminares para: (A) Formación de benzonitrilo a partir de bencilazida; (B) Posible mecanismo de reacción para dicha transformación y (C) Aminación C-H intramolecular
Esta línea se está realizando en colaboración con el Prof. Rudi Fasan de la Universidad de Rochester (NY – USA), con quien nuestro grupo a comenzado una estrecha colaboración.
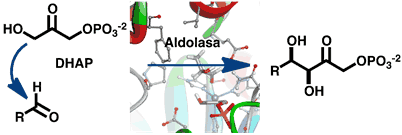
En los últimos años, el grupo ha comenzado a trabajar en el uso de aldolasas para la síntesis de análogos de azúcares. Estas enzimas pertenecen a la clase de las liasas (carbono-carbono liasas, EC 4.1.x.x), y tienen sus funciones naturales en las rutas biosintéticas de carbohidratos y cetoácidos y aminoácidos. Estas enzimas han sido aisladas y purificadas para la producción in vitro de azúcares y glicomiméticos⁴. Nuestro objetivo a largo plazo es el estudio de la viabilidad de su producción y utilización en sistemas biocatalíticos de célula entera, haciendo uso de las rutas metabólicas de la célula, para la obtención de la DHAP necesaria como sustrato dador en la reacción aldólica biocatalítica.
En este sentido, el trabajo experimental se complementa con estudios teóricos del mecanismo de acción de diferentes aldolasas dependientes de DHA.
Este trabajo se realiza en colaboración con las Dras. Paula Rodríguez y Sonia Rodríguez en el Laboratorio de Biocatálisis y Biotransformaciones, y con el Dr. Nicolás Veiga del Depto. Estrella Campos de la Facultad de Química.
Además de las enzimas ya mencionadas, el grupo ha trabajado con lipasas (comerciales) e hidroxinitrilo liasas (comerciales y aisladas de fuentes locales), y deshidrogenasas de hongos filamentosos y levaduras.
Proyectos financiados, habría que agregar (en los dos últimos se desarrollaron procesos catalizados por deshidrogenasas de hongos filamentosos y levaduras):
- “Use of aldolases in Organic synthesis. Optimization of aldol addition reactions using purified enzymes and exploration of the use of whole cells in high density cultures”. Financiado por: Organization for the Prohibition of Chemical Weapons (OPCW). Período 2015-2017.
Responsable: Daniela Gamenara. Monto financiado:€ 20.000. - “Mononuclear non-heme iron oxygenases as biocatalysts for green C-H amination reactions” Financiado por UNESCO/IUPAC/PhosAgro, Premio otorgado por la alianza “Green Chemistry For Life”, Responsable: Ignacio Carrera. Monto: 30.000 usd. Período 2017-2018
- “Exploración del uso de aldolasas utilizando células enteras de microorganismos recombinantes como biocatalizadores. Aplicaciones en síntesis orgánica.” Financiado por Comisión Sectorial de Investigación Científica (CSIC). Modalidad: I+D. Período: 2017-2019. Responsable: Daniela Gamenara. Monto financiado: $ 1.000.000.
- “Síntesis de feromonas de agregación de Sitophilus granarius y Sitophilus orizae, plagas (de granos almacenados) de importancia económica en Uruguay” Financiado por Programa de Desarrollo tecnológico (PDT). Modalidad Areas de Oportunidad: Sanidad Vegetal. Período: 2007-2008. Responsable: Daniela Gamenara. Monto financiado: U$S 40.000.
- “Development of pheromone-based tools for the reduction of pesticide use in the management of agricultural pests in Uruguay: chemical characterization and chemoenzymatic synthesis of pheromones” Financiado por Organization for the Prohibition of Chemical Weapons (OPCW). Período: 2007-2009. Responsables: Daniela Gamenara-Andrés González. Monto financiado: U$S 17.000.
1.- “Microbial degradation of organic compounds”; Gibson, D. Marcel Dekker: New York, 1984; Vol. 13.
2.- “Redox Biocatalysis: Fundamentals and Applications”, Gamenara, D.; Seoane, G. A.; Saenz-Méndez, P; Domínguez de María, P. J. Wiley & Sons: Hoboken, NJ, USA, 2013, capítulo 4, pág. 251-274.
3.- a) “Selectivity in the halohydroxylation of cyclohexadienediols”, Carrera, I.; Brovetto, M.; Seoane, G. Tetrahedron 2007, 63, 4095-4107; b) “Selenium-catalyzed iodohydrin formation from alkenes”, Carrera, I.; Brovetto, M.; Seoane, G. Tetrahedron Lett. 2006, 47, 7849-52. c) “Chemoenzymatic synthesis of enantiopure α-substituted cyclohexanones from aromatic compounds”, Fonseca, G.;Seoane, G. Tetrahedron: Asymmetry, 2005, 16(7), 1393-1402. d) “Chemoenzymatic synthesis of chiral enones from aromatic compounds”. Schapiro, V.; Cavalli, G.; Seoane, G.; Faccio, R.; Mombrú, A., Tetrahedron: Asymmetry, 2002, 13, 2453-2459. e) “(S)-Tricarbonyl[(1,2,3,4-)-(5R,6S)-1-chloro-5,6-dimethoxycyclohexa-1,3-diene]iron(0)”, Russi, S.; Suescun, L.; Mombrú, A.; Pardo, H.; Mariezcurena, R.; Cavalli, G.; Seoane, G., Acta Cryst. 2000, C56, 820 – 821. f) Osmylation of chiral cis-cyclohexadienediols”. Brovetto, M.; Schapiro, V.; Cavalli, G.; Padilla, P.; Sierra, A.; Seoane, G.; Suescun, L.; Mariezcurrena, R., New J. Chem. 1999, 23, 549 – 556. g) “Chemoenzymatic Synthesis of Unnatural Amino Acids via Modified Claisen Rearrangement of Glycine Enolates. Approach to Morphine Synthesis”. Gonzalez, D.; Schapiro, V.; Seoane, G.; Hudlicky, T.; Abboud, K., J. Org. Chem. 1997, 62, 1194 – 1195.
4.- Brovetto, M.; Gamenara, D.; Saenz Méndez, P.; Seoane, G. C-C bond forming lyases in organic
synthesis. Chem. Rev. 2011, 111 (7), 4346).
Proyectos asociados
-
- “Nuevas reacciones con Dioxigenasas tipo Rieske:expandiendo el poder catalítico del hierro”, financiado por: Fondo Vaz Ferreira – Dirección Nacional de Innovación, Ciencia y Tecnología (DICYT), Ministerio de Educación y Cultura. Período: 2022 – 2024. Responsable: Agustina Vila. Monto financiado: $ 190.000
- “Use of aldolases in Organic synthesis. Optimization of aldol addition reactions using purified enzymes and exploration of the use of whole cells in high density cultures”. Financiado por: Organization for the Prohibition of Chemical Weapons (OPCW). Período 2015-2017.
Responsable: Daniela Gamenara. Monto financiado:€ 20.000.
- “Nuevas reacciones con Dioxigenasas tipo Rieske:expandiendo el poder catalítico del hierro”, financiado por: Fondo Vaz Ferreira – Dirección Nacional de Innovación, Ciencia y Tecnología (DICYT), Ministerio de Educación y Cultura. Período: 2022 – 2024. Responsable: Agustina Vila. Monto financiado: $ 190.000
-
- “Producción de novedosos cis-ciclohexadienodioles utilizados como materiales de partida en síntesis orgánica” Financiado por “Agencia Nacional de Investigaciòn e Innovación” Convocatoria Fondo Clemente Estable 2014. Ejecución 2015-2017. Monto Financiado: $u 1.300.000.
Responsable: Ignacio Carrera
- “Producción de novedosos cis-ciclohexadienodioles utilizados como materiales de partida en síntesis orgánica” Financiado por “Agencia Nacional de Investigaciòn e Innovación” Convocatoria Fondo Clemente Estable 2014. Ejecución 2015-2017. Monto Financiado: $u 1.300.000.
-
- “Oligómeros quirales mediante biotransformación de aromáticos. Aplicaciones supramoleculares”, Financiado por “Agencia Nacional de Investigaciòn e Innovación” Convocatoria Fondo Clemente Estable 2014. Ejecución 2015-2017. Monto Financiado: $u 1.300.000. Responsable: Gustavo Seoane
-
- Aproximación quimioenzimática a la síntesis del fragmento C6-C13 de Amfidinolidas de la serie-T Financiación: CSIC, Modalidad: Iniciación a la Investigación, $250.000 (2010-2011)
-
- Biotransformación de aromáticos en la preparación de isolaulimalida, financiado por PDT, 2006-2007.
-
- Síntesis y evaluación biológica de bengamidas y derivados mediante biotransformaciones, financiado por CSIC-299, 2005-2006.
Publicaciones
“New mechanistic insights into the reversible aldol reaction catalyzed by Rhmanulosa-1-phospate aldolase from Escherichia coli”, Rigual, A.; Cantero, J.; Risso, M.; Rodríguez, P.; Rodríguez, S.; Paulino, M.; Gamenara, D.;* Veiga, N.* Molecular Catalysis 2020, 495, 111131. [DOI: 10.1016/j.mcat.2020.111131].
“Site-Directed Mutagenesis Studies on the Toluene Dioxygenase Enzymatic System: Role of Phenylalanine 366, Threonine 365, and Isoleucine 324 in the Chemo-, Regio-, and Stereoselectivity” Vila, M.A.; Umpiérrez, D.; Veiga, N.; Seoane, G.; Carrera, I.; Rodríguez Giordano, S.; Advanced Synthesis and Catalysis 2017, 359, 12, 2149-2157
“Toluene Dioxygenase-Catalysed Oxidation of Benzyl Azide to Benzonitrile: Mechanistic Insights for an Unprecedented Enzymatic Transformation”, Vila, M. A.; Pazos, M.; Iglesias, C.; Veiga, N.; Seoane, G.; Carrera, I.* ChemBioChem 2016, 17, 291-295.
“Novel chemoenzymatic synthesis of an enantiopure allo-inosamine from benzyl azide”, de la Sovera, V.; Garay, P.; Thevenet, N.; Macías, M. A.; González, D.; Seoane, G.; Carrera, I.* Tetrahedron Lett. 2016, 57, 2484-2487.
“Computational insights into the oxidation of mono- and 1,4 disubstituted arenes by the Toluene Dioxygenase enzymatic complex” Vila, M.A.; Umpiérrez, D.; Rodríguez, S.; Seoane, G.; Carrera, I.; Veiga, N.* Journal of Molecular Catalysis B: Enzymatic 2016, 133, S410-S419
“Double [3,3]-sigmatropic rearrangement in the enzymatic dioxygenation of benzyl azide: preparation of novel synthetically valuable azido-diols”, Thevenet, N.; de la Sovera, V.; Vila, M. A.; Veiga, N.; González, D.; Seoane, G.; Carrera I.* Lett. 2015, 17, 684-687.
“Stereoselective hydrogenation of methylcyclohex-2-ene-1,4-diols used in the synthesis of ampelomins and deoxy-carbasugars”. Lagreca, M.E.; Carrera, I.; Seoane, G.A.; Brovetto, M. Tetrahedron Letters 2014, 55, 853-6.
“Concise and stereoselective chemoenzymatic synthesis of Sitophilate, the male-produced aggregation pheromone of Sitophilus granarius (L.)”. Ravía, S.; Risso, M.; Kröger, S.; Vero, S.; Seoane, G.; Gamenara, D.* Tetrahedron: Asymmetry 2013, 24 (19), 1207-1211.
“Chemoenzymatic preparation of (6R)-5,6-dihydro-2H-pyran-2-one: an ubiquitous structural motif of biologically active lactones”. Carrera, I.; Brovetto, M.; Seoane, G. Tetrahedron: Asymmetry 2013, 24, 1467-72.
“Production of cis-1,2-dihydrocatechols with high synthetic value by whole-cell fermentation using Escherichia coli JM109 (pDTG601): a detailed study” Vila, María A.; Brovetto, M.; Gamenara, D.; Bracco, P.; Zinola, G.; Seoane, G.; Rodríguez, S.; Carrera, I. J. Mol. Catal. B, Enzym. 2013, 96, 14-20.
“Chemoenzymatic Synthesis of trans-Tetrahydrofuran Cores of Annonaceous Acetogenins from Bromobenzene”. Ramos, J.-C.; Brovetto, M.; Seoane, G. Org. Lett. 2013, 15, 1982-1985.
“Microwave-assisted solvent-free lipase catalyzed transesterification of β-ketoesters”. Risso, M.; Mazzini, M.; Kroger, S.; Saenz-Mendez, P.; Seoane, G.; Gamenara, D. Green Chem. Lett. Rev. 2012, 5, 539-543.
“Concise chemoenzymatic synthesis of methyl D-2,3- dideoxyriboside”, Ramos, J.C.; Bracco, P.; Mazzini, M.; Fernández, J.R.; Gamenara, D.; Seoane, G.A. Tetrahedron: Asymmetry 2010, 21, 969-972.
“Novel Fungi-catalyzed reductions of α-alkyl-β-keto esters”. Ravía, S.; Carrera, I.; Seoane, G.; Vero, S.; Gamenara, D. Tetrahedron: Asymmetry 2009, 20 (12), 1393-1397.
“Regioselective epoxide ring-opening using boron trifluoride diethyl etherate. DFT study of an alternative mechanism to explain the formation of syn-fluorohydrins”. Saenz, P.; Cachau, R.; Seoane, G.; Ventura, O.N. J. Mol. Structure 2009, 904, 21-27.

